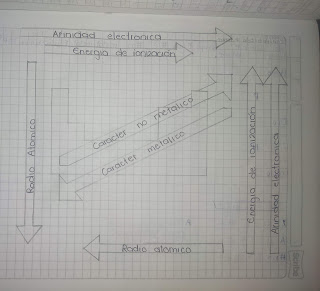
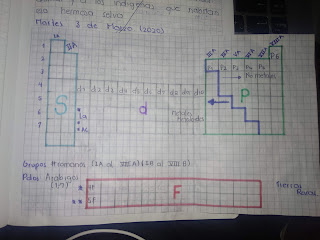
Semana #10
Tema: Modelo actual del átomo Objetivos: Describir el modelo actual del átomo teniendo en cuenta los números cuánticos. Partiendo de la presentación se debe responder el siguiente cuestionario: Qué es un orbital? Un orbital atómico es la región del espacio donde se mueven los electrones, los cuales no tienen una trayectoria definida, ya que es imposible conocer la posición de un electrón de un orbital en un momento determinado. Definir cada uno de los siguientes números cuánticos y decir los valores que pueden tomar. Numero cuántico principal: A medida que N aumenta, la probabilidad de encontrar el electrón cerca del núcleo disminuye y la energía del orbital aumenta. Puede tomar los valores enteros positivos: N= 1, 2, 3, 4, 5, 6, 7. Si en un elemento químico su último nivel es el 3s, su número cuántico principal es el 3. Número cuántico secundario: El número cuántico secundario es L (l = 0,1,2,3,4,5,...,n-1), indica la forma de los orbitales y el subnivel de energí